Raman-spektroskopi kombinerat med bildbehandling och patch clamp-teknik för studier av lungartärsmuskelceller
I detta projekt har vi utvecklat en märkfri teknik baserad på Raman-spektroskopi i kombination med mikrofluidik och patch clamp-teknik för att studera biomolekylära och mekaniska egenskaper hos mjuka muskelceller i lungartärer.
Bakgrund
I detta projekt har vi utvecklat en märkfri teknik baserad på Raman-spektroskopi i kombination med mikrofluidik och patch clamp-teknik.
Målet var att mäta och förstå funktionen hos lungartärer under syrebrist och att lära oss mer om de biomolekylära och mekaniska processerna hos mjuka muskelceller i lungartärer (PASMCs) under hypoxisk lungkärlsförträngning (HPV) och lungartärhypertension (PH). Lungartärhypertension (PH) innebär ökat blodtryck i lungens blodkärl. Denna livshotande och progressiva sjukdom har endast mycket begränsad behandling och det finns för närvarande ingen bot [1, 2].
Världshälsoorganisationen (WHO) klassificerar PH i fem grupper, där grupp III (PH associerad med hypoxi och/eller lungsjukdom) betraktas som den näst vanligaste orsaken till höjt blodtryck i lungartärerna. Riskfaktorer för denna form av PH inkluderar kronisk obstruktiv lungsjukdom (KOL), sömnapné, men också kronisk exponering för hög höjd. Denna allvarliga störning är - åtminstone delvis - beroende av hypoxisk lungkärlsförträngning (HPV). HPV är en fysiologisk mekanism som förtränger lungartärerna genom att förkorta PASMCs som svar på syrebrist (hypoxi) i lungan [3, 4]. På så sätt optimerar HPV gasutbytet och upprätthåller optimal syremättnad i artärerna under regionala ventilationssvårigheter [4].
Den här vitala mekanismens påverkan blir uppenbar vid lungsvikt som den som för närvarande uppstår i Covid-19-pandemin: otillräcklig gasutbyte på grund av störd HPV leder ofta till död vid lunginfektioner som antingen orsakas av bakterier eller virus, som Sars-CoV-2. Dessutom leder utbredd och kronisk hypoxi i lungorna, till exempel på grund av kroniska lungsjukdomar, till PH på grund av HPV och efterföljande ombyggnadsprocesser i lungartärerna [5, 6]. Som ett resultat måste höger kammare i hjärtat kompensera för den ökade kärlmotståndet, vilket i slutändan - på grund av den konstanta arbetsbelastningen - kan leda till hjärtsvikt [7]. Därför är förståelse för de underliggande mekanismerna bakom HPV en förutsättning för att utveckla behandlingsstrategier för livshotande lungsjukdomar som påverkar HPV.
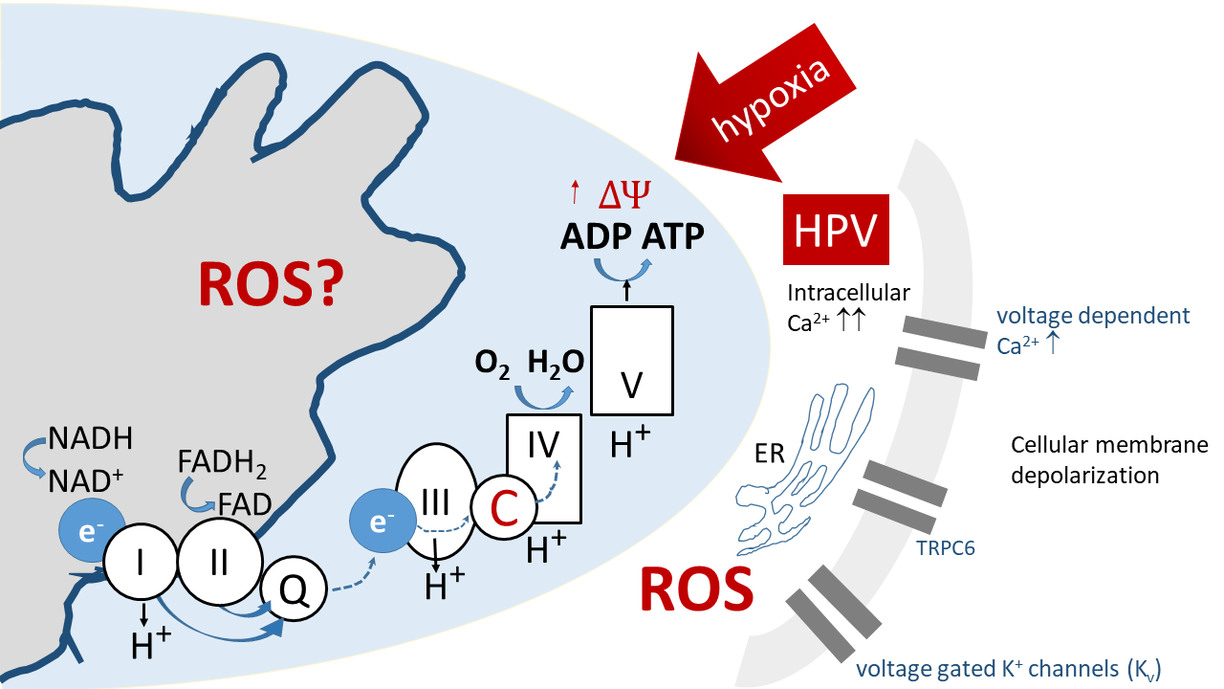
Figur 1: Hypoxi inducerar hyperpolarisering av mitokondriemembranet, en ökning av frisättningen av mitokondriella superoxid (ROS) och efterföljande hämning av kaliumkanaler (Kv), vilket utlöser depolarisering av cellmembranet och aktivering av spänningsstyrda kalciumkanaler som leder till ökad intracellulär Ca2+ och därmed HPV. De streckade pilarna antyder okända vägar.
PASMCs är de viktigaste sensor- och effektorcellerna som ligger bakom hypoxi-inducerad lungartärshypertension och andra former av PH [4]. De finns i väggen i lungornas kapillärkärl och har förmågan att känna av akut syrebrist i lungalveolerna. Under dessa omständigheter förtränger de omedelbart (HPV), vilket förtränger lungkärlen - och därigenom omdirigerar blodflödet till områden med högre syreinnehåll. HPV är unik för lungcirkulationen och är avgörande för att bibehålla artärernas syremättnad. Syresensormekanismerna och signaleringen som ligger till grund för HPV är ännu inte helt klarlagda. Under akut HPV - som generellt varar i sekunder till minuter - verkar HPV till stor del bero på frisättning av reaktiva syresubstanser (ROS) som medieras av olika signaleringskaskader, vilka involverar mitochondrial redox-reaktioner [8]. HPV, som har en mångfacetterad natur enligt figur 1, anses ha flera hypoxi-känsliga komponenter som bidrar till HPV [4, 9]. Å andra sidan drivs kroniska hypoxiska lungreaktioner som varar i flera minuter till timmar av olika mekanismer.
Metoder
Mikrofluidsystem
Eftersom HPV utlöses av syrebrist måste en experimentell uppställning inkludera ett system som möjliggör kontroll över snabba skift i syrgaskoncentrationen i närheten av PASMCs. Vi har utformat ett gasäte mikrofluidsystem, se figur 2a. Designen stödjer multimodala mätningar med patch clamp-tekniken och optisk undersökning samtidigt som den spårar syrgaskoncentrationen [10]. Ett perfusionssystem levererar en konstant ström av näringsämnen i biologiska buffertar till provet i kammaren. Dessutom kan perfusionssystemet skapa smidiga skift mellan normoxiska och hypoxiska lösningar - vilket resulterar i en stegrespons på grund av skift i syrgasens tillgänglighet. Designen av systemet stöddes av simuleringar av kammaren, se figur 2b. Det var också avgörande att fastställa att patchpipettkanalen inte skulle översvämma, eftersom det skulle göra mätningar omöjliga. Simuleringarna visade att vätskeuppbyggnaden i patchpipettkanalen var låg samtidigt som en konstant flöde i kammaren bibehölls, se figur 2c. Simuleringen av det fluidiska systemet utfördes i samarbete med Fluid Mechanics vid LTU med användning av ANSYS.
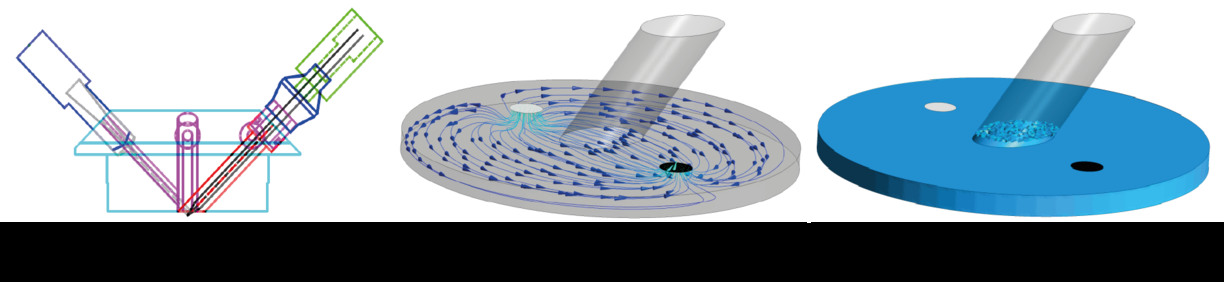
Figur 2: Design av gasäte mikrofluidsystem. (a) CAD-design - (vänster) syresensor, (mitten) flödesinlopp/utlopp och (höger) patchpipett. (b) Simulering av flöde i kammaren i det fluidiska systemet. (c) Visualisering av vätskeuppbyggnad i patchpipettkanalen.
Patch Clamp
Patch Clamp-tekniken är en elektrofysiologisk metod som används för att mäta aktiviteten hos jonkanaler i cellmembranet [11]. Cellerna använder jonkanaler för att kommunicera med sin omgivning eller för att driva biokemiska reaktioner. PASMCs svarar på syrebrist genom att skapa en inflöde av kalciumjoner genom membranet, vilka binder till proteinet kalmodulin. Genom att fästa en pipett på membranet hos en PASMC kan förändringar i jonkoncentrationen upptäckas genom potentiella skillnader, och jonkanalernas dynamik kan följas. En översikt över en patchpipett som bildar en tätning med membranet hos en PASMC kan ses i figur 3.

Figur 3: Patchpipett när den bildar en tätning med membranet hos en glatt muskelcell i lungartär (PASMC), för att undersöka dynamiken hos jonkanalerna. (Med tillstånd från våra samarbetspartners vid Justus Liebig University.)
Raman-spektroskopi
Raman-spektroskopi är ett märkfritt spektroskopiskt verktyg som ger information om molekylära vibrationer i en prov. En Raman-spektrum är unikt för varje given molekyl; det visar energiskillnaden (i omvända centimeter) mellan inkommande exciterande fotoner och de inelastiskt Raman-spridda fotonerna. Raman-spektroskopi är extremt känslig och informativ när det gäller typ, tillstånd, ordning och mängd av molekyler i ett prov. Raman-spektroskopi har vidare används brett för att studera mitokondriernas redoxtillstånd, kroppens kraftverk för alla levande system [12-15]. En schematisk bild av den multimodala uppställningen kan ses i figur 4.
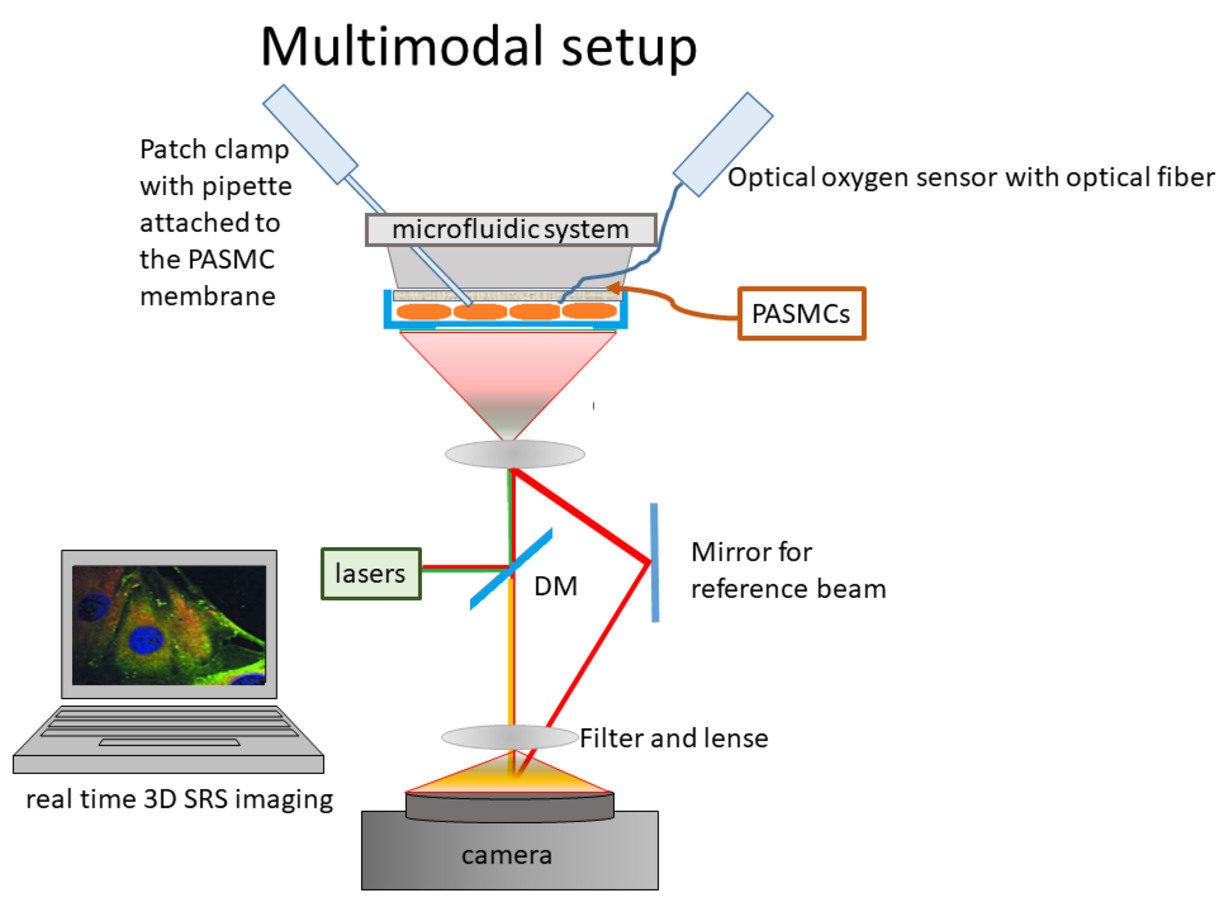
Figur 4: En schematisk bild av den multimodala uppställningen. Patchpipetten och syresensorn infogas i mikrofluidsystemet genom ett utformat kanalsystem. Raman-spektroskopi, exciterad av en grön laser (våglängd 532 nm, DPPS, Altechna, inköpt från Azpect Photonics, Solna, Sverige), registreras av en Raman-spektrometer (Shamrock3031, Andor Technology, Belfast, Storbritannien), och cellernas vasokonstriktion registreras med hjälp av LED-ljus och en kamera.
Tack
Vi skulle vilja tacka våra partners vid Justus Liebig University, Giessen, Tyskland. Ett särskilt tack går till Dr. rer. nat. Fenja Knöpp och Prof. Dr. Norbert Weissmann som är en stor tillgång för projektet. Vi skulle också vilja tacka Dr. Anders Andersson på Fluid Mechanics, LTU, för simuleringarna av mikrofluidsystemet. För ekonomiskt stöd skulle vi vilja tacka Vetenskapsrådet (Bidrag 2016-04220), liksom Kempe-stiftelsen och LTU Labbfond.
Referenser
- Bogaard, H.J., et al., The Right Ventricle Under Pressure: Cellular and Molecular Mechanisms of Right-Heart Failure in Pulmonary Hypertension. Chest, 2009. 135(3): p. 794-804.
- Sommer, N., et al., Current and future treatments of pulmonary arterial hypertension. British Journal of Pharmacology. n/a(n/a).
- Sylvester, J.T., et al., Hypoxic Pulmonary Vasoconstriction. Physiological Reviews, 2012. 92(1): p. 367-520.
- Sommer, N., et al., Mitochondrial Complex IV Subunit 4 Isoform 2 Is Essential for Acute Pulmonary Oxygen Sensing. Circ Res, 2017. 121(4): p. 424-438.
- Sommer, N., et al., Oxygen sensing and signal transduction in hypoxic pulmonary vasoconstriction. European Respiratory Journal, 2016. 47(1): p. 288-303.
- Savai, R., et al., Pro-proliferative and inflammatory signaling converge on FoxO1 transcription factor in pulmonary hypertension. Nat Med, 2014. 20(11): p. 1289-300.
- Barberà, J.A., V.I. Peinado, and S. Santos, Pulmonary hypertension in chronic obstructive pulmonary disease. European Respiratory Journal, 2003. 21(5): p. 892-905.
- Sommer, N., et al., Mitochondrial Complex IV Subunit 4 Isoform 2 Is Essential for Acute Pulmonary Oxygen Sensing. Circulation Research, 2017. 121(4): p. 424-438.
- Sommer, N., et al., Bypassing mitochondrial complex III using alternative oxidase inhibits acute pulmonary oxygen sensing. ScienceAdvances, 2020. in press.
- Knoepp, Fenja, et al. "Development of a Gas-Tight Microfluidic System for Raman Sensing of Single Pulmonary Arterial Smooth Muscle Cells Under Normoxic/Hypoxic Conditions." Sensors 18.10 (2018): 3238.
- Sakmann, Bert, and Erwin Neher. "Patch clamp techniques for studying ionic channels in excitable membranes." Annual review of physiology 46.1 (1984): 455-472.
- Erjavec, N., G. Pinato, and K. Ramser, Raman spectroscopy as a tool for detecting mitochondrial fitness. Journal of Raman Spectroscopy, 2016. 47(8): p. 933-939.
- Denton, M.L., et al. Redox reactions of cytochrome c in isolated mitochondria exposed to blue or red lasers using resonance Raman spectroscopy. in Progress in Biomedical Optics and Imaging - Proceedings of SPIE. 2018.
- Kitt, J.P., et al., Raman Spectroscopy Reveals Selective Interactions of Cytochrome c with Cardiolipin That Correlate with Membrane Permeability. Journal of the American Chemical Society, 2017. 139(10): p. 3851-3860.
- Perry, D.A., et al., Responsive monitoring of mitochondrial redox states in heart muscle predicts impending cardiac arrest. Science Translational Medicine, 2017. 9(408).
- Amer, E., Gren, P., Ramser, K., & Sjödahl, M. (2018). Measurement of selective species concentration using spectroscopic holography. In Speckle 2018 : VII International Conference on Speckle Metrology (Vol. 10834). https://doi.org/10.1117/12.2319386
Uppdaterad:
