Holografisk Raman-avbildning av biomolekylära och mekaniska egenskaper hos mjuka muskelceller
I detta projekt utvecklar vi en etikettfri teknik baserad på tredimensionell (3D) holografisk och mikroskopisk stimulerad Raman-spridning (microSRS) i kombination med mikrofluidik. Målet är att mäta och förstå funktionen hos lungartärer under syrebrist och att lära oss mer om biomolekylära och mekaniska processer hos mjuka lungmuskelceller (PASMCs) under hypoxisk lungvasokonstriktion (HPV) och lungartärhypertoni (PH).
Transporten av syre genom lungorna in i vårt blodomlopp är avgörande för vår funktion. Evolutionen har skapat ett fascinerande backup-system för att upprätthålla ventilationen vid akut syrebrist. Akut syrebrist i lungans alveoler leder till hypoxisk lungvasokonstriktion (HPV) med PASMCs som utförarceller. Dessa celler börjar omedelbart att dra ihop sig vid hypoxi, se figur 1, vilket omfördelar blodflödet till områden med högre syreinnehåll, vilket är avgörande för att optimera och upprätthålla gasutbytet under förhållanden med regional alveolär hypoxi. Sådana förhållanden förekommer redan hos friska människor men kan vara livshotande om HPV störs av lunginflammation, sepsis, under anestesi eller vid leversvikt [1].
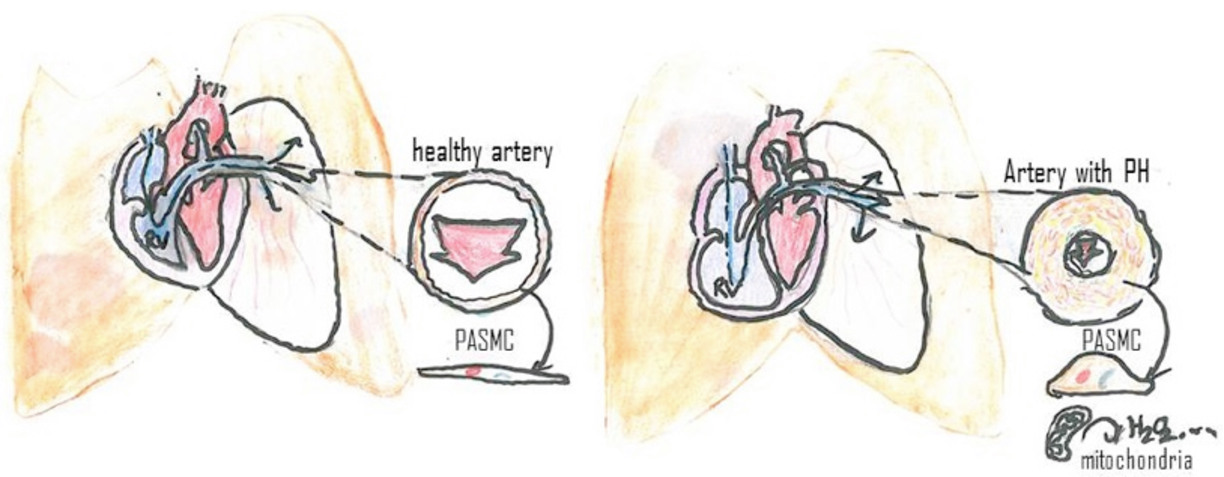
Figur 1) På vänster sida, en frisk artär och en avslappnad PASMC. Blod- och syreflödet är obehindrat och höger kammare är i normalt tillstånd. Till höger genererar hypoxi en signaleringsskaskad i PASMC:s mitokondrier, vilket leder till ökad pulmonell kärlmotstånd på grund av vasokonstriktion samt kärlomvandling, med en efterföljande ökning av högerkammarbelastning, högerkammarhypertrofi och risken för höger hjärtsvikt.
Vi utvecklar tredimensionell (3D) holografisk och mikroskopisk stimulerad Raman-spridning (microSRS) i kombination med mikrofluidik. Systemet har potential att snabbt och samtidigt identifiera och analysera biomolekylära signaler och mekaniska händelser i PASMCs under syrebrist. Holografisk microSRS kommer förhoppningsvis att ge nya insikter och leda till nya terapeutiska medel mot pulmonell hypertension.
Första resultaten av SRS-setupen i transmissionsläge
Första SRS-hologram har registrerats och faskontraster har återställts i transmissionsläget [2]. En schematisk bild av uppställningen, med experimentella förhållanden för torskleverolja, kan ses i figur 2.
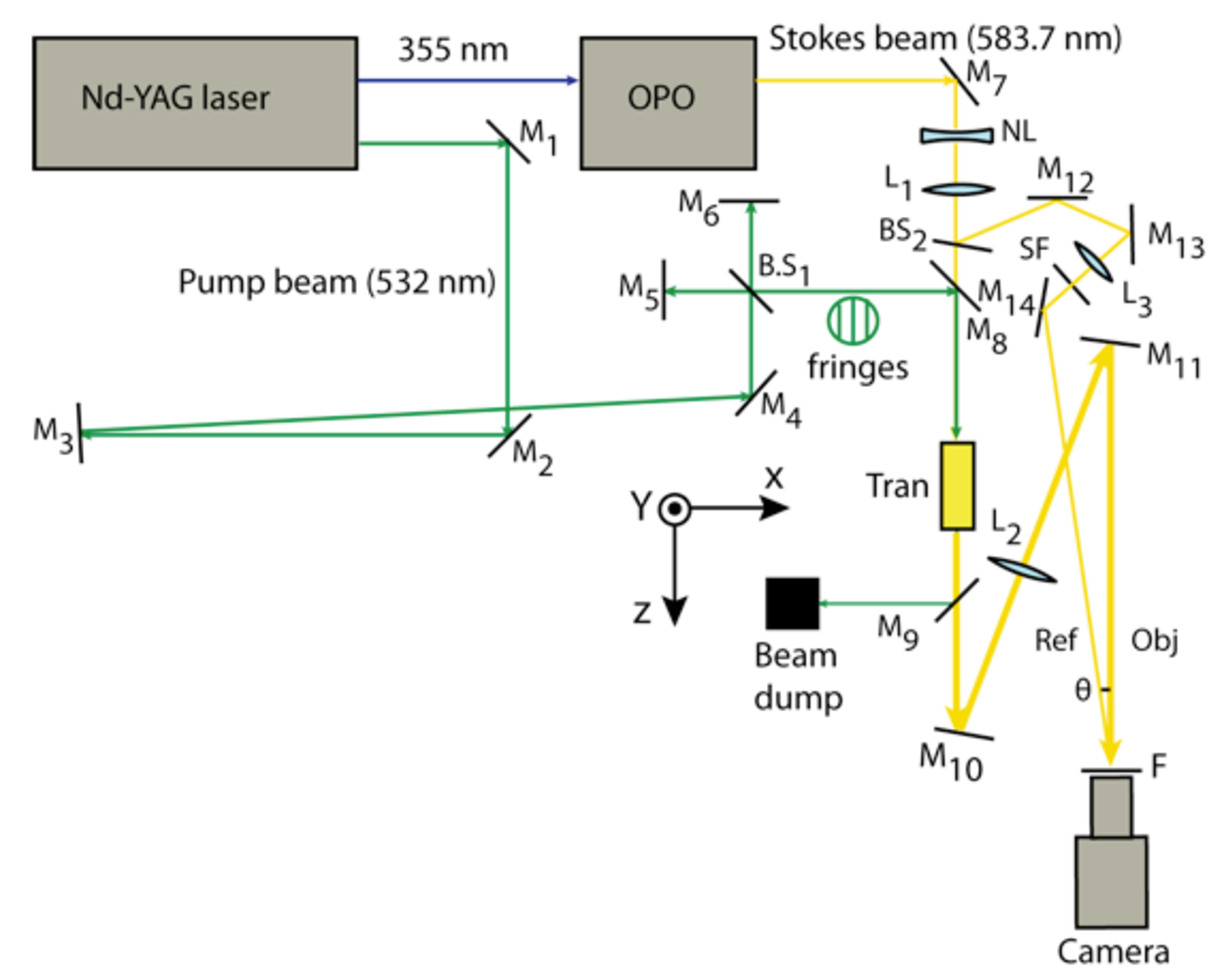
Figur 2) Schematisk bild av den experimentella uppställningen för holografisk SRS-bildbehandling. Nd-YAG-laser som avger dubblerad frekvens (532 nm, pumpstråle) och tredubblad frekvens (355 nm) pulser. Den 355 nm linjen passerar OPO där den korrekta Stokes-våglängden genereras (Stokes-stråle). Stokes-strålen delas upp i två olika banor, det vill säga objektstrålen som passerar provet och referensstrålen som går direkt till kameran. Pumpstrålen passerar en Michelson-interferometer för att producera ränder för spatial modulation. M: spegel, B.S: strålsplitter, NL: negativ lins, L1: kollimeringslins, L2: avbildningslins, F: absorberande filter.
SRS-systemet byggdes upp i John Fields laboratorium vid LTU. De första resultaten visar att uppställningen baserad på spatial modulation producerar en pålitlig stimulerad Raman-gain i torskleverolja med endast en laserpuls per bild, se fig. 3. För att hämta SRS-signalen registrerades en bild av pumpstrålen (fig. 3a) och två bilder av Stokes-strålen utan (fig. 3b) och med (fig. 3c) pumpstrålränderna närvarande. Den normaliserade bilden beräknades och Fourier-transformerades (fig. 3d). Därefter separerades Stokes-strålens vinst från bakgrunden i Fourier-domänen (fig. 3e).
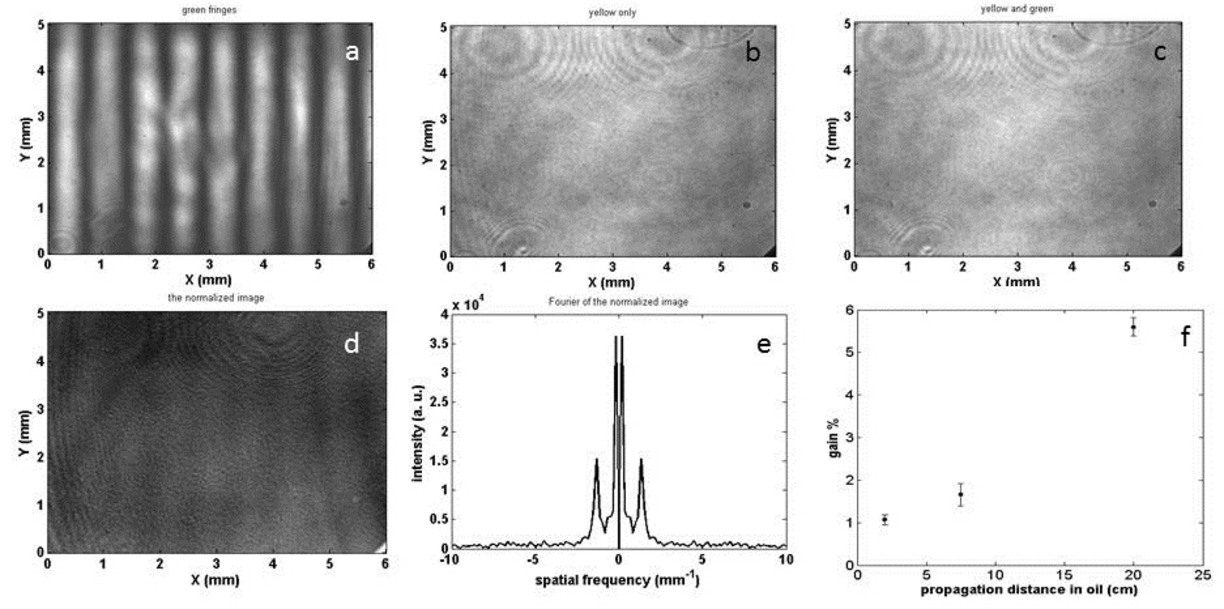
Fig. 3) (a) Bild av pumpstrålens ränder, (b) Stokes-strålbild utan och (c) med pumpstrålens ränder närvarande, samt (d) normaliserad bild av de två föregående, (e) fft av (d), (f) graf som visar SRS-gain i procent med olika provstorlekar (20 cm, 7 cm och 2 cm).
Som kan ses i figur 3f verkar inte SRS-gewinn i torskleverolja följa en teoretiskt förväntad linjär trend av en signalökning. Detta leder oss till förslaget att en termisk konvektion orsakad av förlängd laserbestrålning påverkade provet. Detta bekräftades genom att spela in en tidsserie av fasbilder under en minut; fasavbildningen visade en ökad termisk konvektion i torskleveroljan, se figur 4. Den termiska effekten kommer att undersökas ytterligare på PASMCs; dock kommer integreringstiden vara mycket kortare och kan ha mindre påverkan.
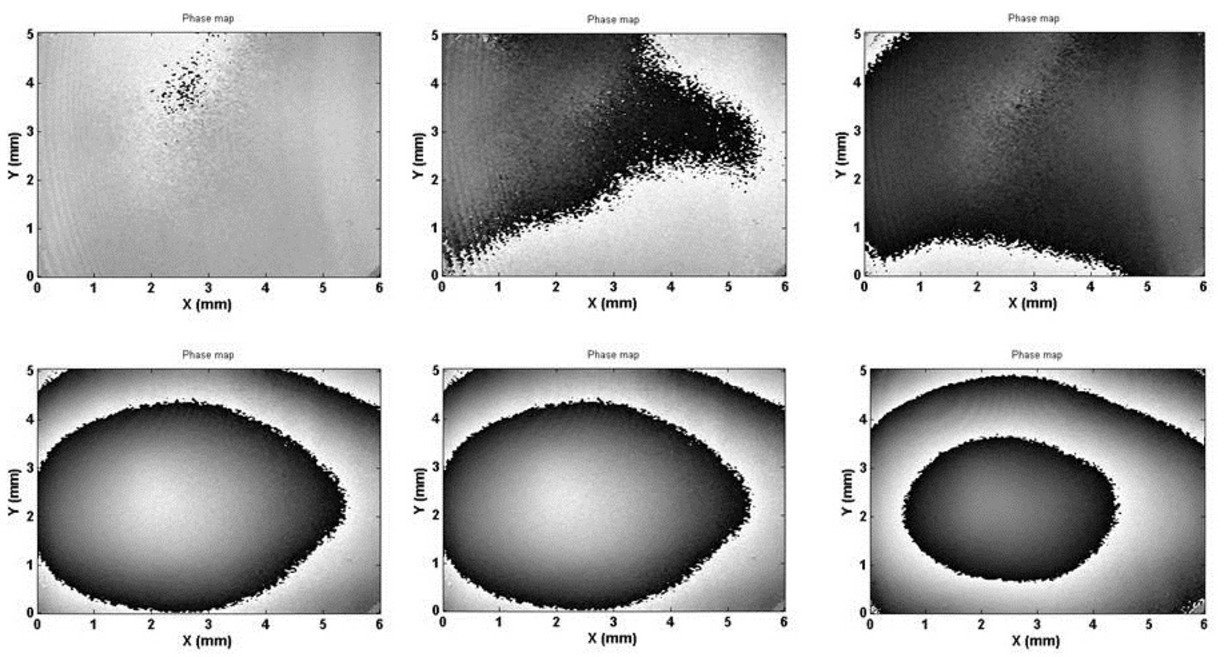
Figur 4) Tidsserie av fasbilder som börjar ovan till vänster, 2 pulser, 35 pulser, 50 pulser, nedan från vänster; efter 1 minut, efter 1 minut & 15 pulser, efter 1 minut & 44 pulser.
Resultaten visar att rörelse och molekylärt innehåll kan avbildas samtidigt.
Första resultaten av resonans Raman-spektroskopi på PASMCs
Experimenten utfördes vid Excellence Cluster Cardio-Pulmonary Systems (ECCPS) vid Justus Liebig University i Giessen, Tyskland. PASMCs från möss odlades i kärl som är lämpliga för mikroskopiska undersökningar, se vänster sida av fig. 5. Efter inkubation placerades kärlen på ett hemgjort mikroskop som var fiberkopplat till en Raman-spektrometer. Lösningen uppvärmdes till 37°C för att skapa fysiologiska förhållanden, se fig. 5, höger sida. Mätningar utfördes med ett perfusionssystem som kunde växla mellan normoxiska (21% O2) och hypoxiska (4% O2) villkor.

Fig 5.) Vänster sida, fotografi av uppsättningen, börjande med en bärbar dator kopplad till spektrometern som var fiberkopplad till mikroskopet. Höger sida, fotografi av kärlet monterat på en uppvärmningsplatta på mikroskopets scen med in- och utlopp för buffertlösningen.
Integrationstiden var inställd på 10 sekunder, och exciteringsvåglängden var 532 nm. Först togs en spektrum i den normoxiska tillståndet, därefter byttes den normoxiska buffertlösningen till en syrefattig buffertlösning medan Raman-spektra togs kontinuerligt. Efter fyra minuter nådde syrekoncentrationen 4%, vilket betraktades som hypoxiskt, och buffertlösningen byttes tillbaka till normoxisk. Efter ytterligare fyra minuter nåddes det återhämtade tillståndet, och experimentet avslutades. Figur 6 visar medelvärdet (n=6) av de första spektrumen, de hypoxiska spektrumen efter 4 minuter och efter 8 minuter (återhämtat tillstånd). Skillnadsspektrumen visar det första spektrumet minus spektrumet efter 4 eller 8 minuter respektive för att undersöka spektralförändringarna över tid.
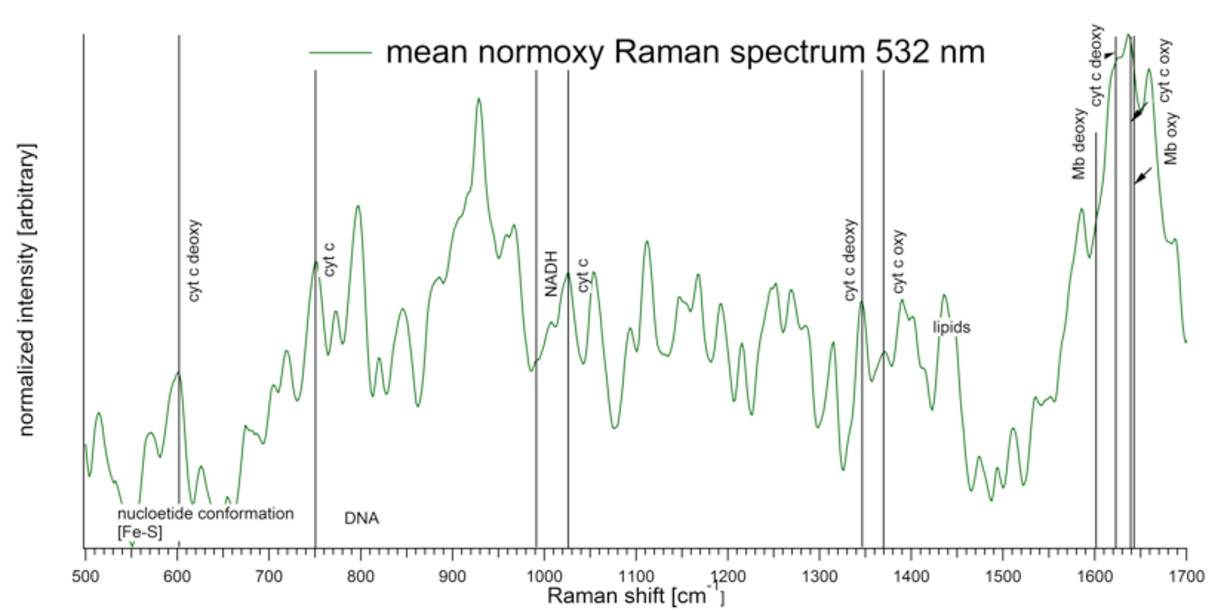
Figur 6) Normaliserat spektrum i normoxiskt tillstånd med Raman-bandtilldelning.
Från datan kan man se att 532 nm excitationslinjen är i resonans med heme-proteinerna, men även nukleotidkonformationer och Fe-S-bindningar kan ses. Bandtilldelningarna är enligt referens [3,4].
Tidsförloppet för spektralmätningsserien visas i figur 7, vänster sida. Till höger visas lådplotterna för deoxivärdena från myoglobin vid 1608 cm-1 och cytochrome c vid 1622 cm-1.
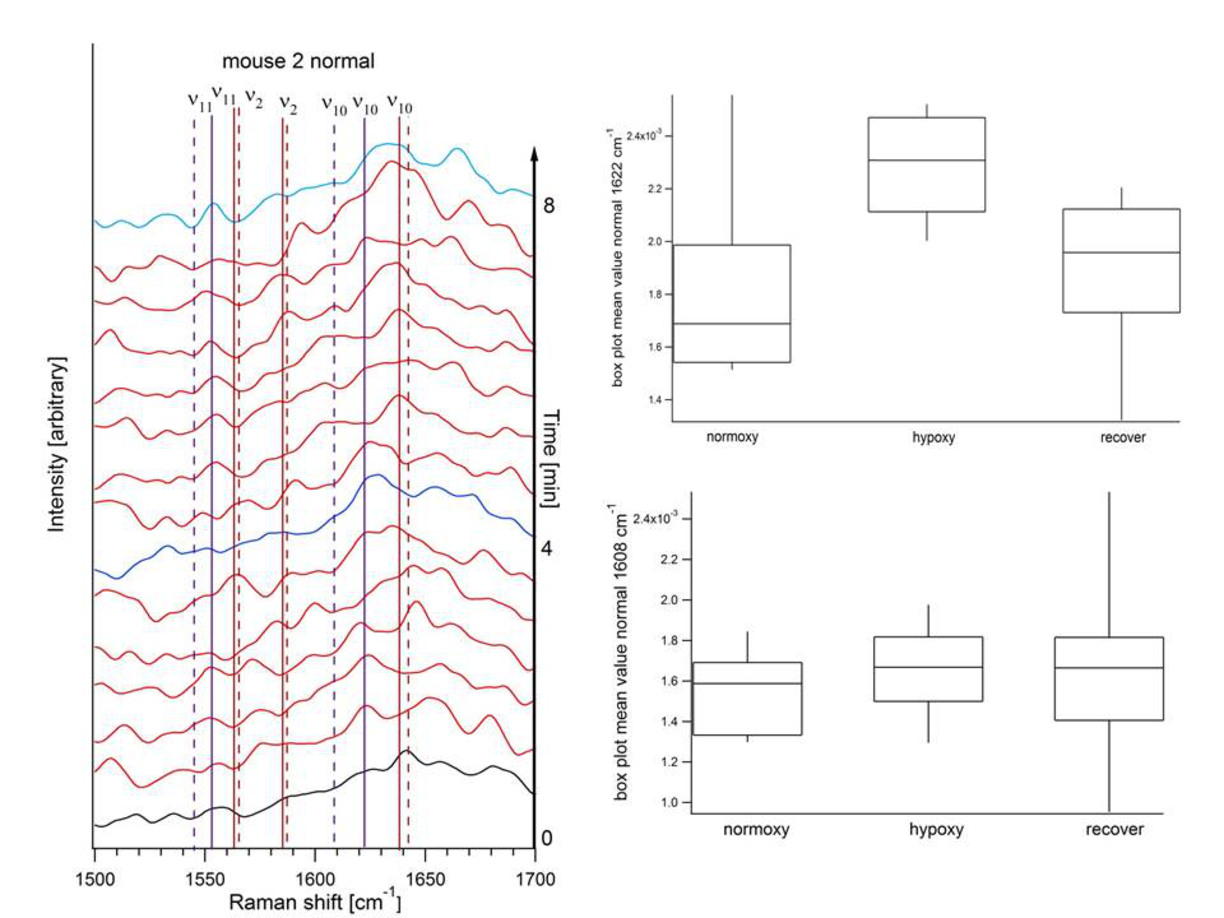
Left hand side: Tidsserien för de 3 experimentella procedurerna. Den första så kallade normoxiska spektret är det understa spektret som visas i svart, de så kallade mixade spektren är i rött och det hypoxiska spektret är blått. Spektret från återhämtningsstadiet visas i ljusblått. Linjerna visar Raman-linjerna för myoglobin (Mb) i punkterade linjer och för cytochrome c (cyt c) i raka linjer. Linjerna för deoxyvärden är blå och linjerna för normoxivärden är röda. Höger sida: Under boxplot för värdena av reducerat Mb vid 1608 cm-1 och ovan boxplot för reducerat cyt c vid 1622 cm-1.
Avser tidsserien, efter det första spektret och efter bytet av buffertlösning kan en omedelbar förändring från den syresatta linjen vid 1638 cm-1 (cyt c) och 1642 cm-1 (Mb) ses, medan den deoxylerade linjen vid 1622 cm-1 (cyt c) och 1608 cm-1 (Mb) stiger. När den normoxiska lösningen slogs på igen återgick den deoxylerade tillståndet till det syresatta tillståndet. I boxploten kan man se att värdet för reducerat Mb visade en liten ökning medan värdet för reducerat cyt c visade en mycket markant ökning under hypoxi. I återhämtningsstadiet återgick värdet för cyt c nästan till det ursprungliga värdet.
Framtiden
Projektet har fått VR-finansiering. Experimenten pågår och det slutliga målet är att ta holografiska stimulerade Raman-spektra av PASMCs vid EPPC i Giessen, Tyskland.
Referenser:
- Malczyk, M., et al., NADPH oxidases—do they play a role in TRPC regulation under hypoxia? Pflugers Archiv European Journal of Physiology, 2016. 468(1): p. 23-41.
- Amer, E., P. Gren, and M. Sjodahl, Stimulated Raman scattering signals recorded by the use of an optical imaging technique. Appl Opt, 2015. 54(20): p. 6377-85.
- Almohammedi, A., et al., Spectroscopic analysis of myoglobin and cytochrome c dynamics in isolated cardiomyocytes during hypoxia and reoxygenation. Journal of the Royal Society Interface, 2015. 12(105).
- Erjavec, N., G. Pinato, and K. Ramser, Raman spectroscopy as a tool for detecting mitochondrial fitness. Journal of Raman Spectroscopy, 2016, 47, 933-939.
Uppdaterad:
